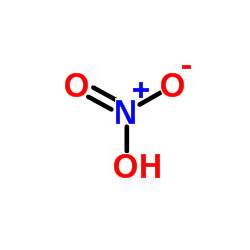
اسید سیتریک یا جوهر لیمو یکی از اسیدهای آلی است که هم در لیموترش و هم پرتقال وجود دارد. فرمول شیمیایی آن C6H8O7 میباشد؛ و نام آیوپاک آن 2-Hydroxypropane-1,2,3-tricarboxylic acid است. کشف این اسید به جابر بن حیان نسبت داده میشود
سالانه بیش از دو میلیون تن اسید سیتریک در جهان تولید میشود. از این ماده بهطور گستردهای به عنوان ترش کننده، طعم دهنده یا یک عامل کیلاته کننده استفاده میشود
اسید سیتریک یک هیدروکسی اسید است. هیدروکسی اسیدها گروهی از اسیدهای کربوکسیلیک هستند که یک گروه عاملی هیدروکسیل به آنها افزوده شدهاست.
وقوع طبیعی و تولید صنعتی
اسید سیتریک یا جوهر لیمو یکی از اسیدهای آلی است که در لیموترش و پرتقال وجود دارد. یکی از عمدهترین کشورهای تولیدکننده آن کشور چین میباشد. یکی از سادهترین روشهایی که برای تولید آن بهکار میرود استفاده از قارچ آسپرژیلوس نایجر است.
تولید جهانی اسید سیتریک در سال ۲۰۱۸ بیش از ۲٬۰۰۰٬۰۰۰ تن بود. بیش از ۵۰٪ از این حجم در چین تولید شدهاست. بیش از ۵۰٪ به عنوان تنظیم کننده اسیدیته در نوشیدنیها، حدود ۲۰٪ در سایر کاربردهای غذایی، ۲۰٪ برای مواد شوینده و ۱۰٪ برای موارد دیگر به غیر از مواد غذایی مانند مواد آرایشی، دارویی و در صنایع شیمیایی استفاده میشود.
در سال ۲۰۱۶ اندازه بازار جهانی اسید سیتریک ۲٫۵۰ میلیارد دلار بود
ویژگیهای شیمیایی اسید سیتریک
این ماده میتواند در یک فرم بدون آب یا به عنوان یک مونوهیدرات وجود داشته باشد.
شکل بی آب کریستال از آب گرم به دست میآید، در حالی که مونوهیدرات زمانی ایجاد میشود که اسید سیتریک از آب سرد کریستال شود.
مونوهیدرات میتواند در حدود ۷۸ درجه سانتی گراد به شکل بی آب تبدیل شود. اسید سیتریک در اتانول مطلق (بدون آب) (۷۶ قسمت اسید سیتریک در هر ۱۰۰ قسمت اتانول) در دمای ۱۵ درجه سانتیگراد حل میشود. با تخریب کربن دی اکسید در بالای ۱۷۵ درجه سانتیگراد تجزیه میشود. از سوی دیگر، pH محلول ۱ میلیمتری این ماده حدود ۳٫۲ است. pH آب میوههای مرکباتی مانند پرتقال و لیمو بستگی به غلظت اسید سیتریک دارد، به طوری که برای غلظت اسیدی بالاتر بیشتر میشود و برعکس.
نمک این ماده را میتوان با تنظیم دقیق pH قبل از کریستالیزاسیون ترکیب آماده کرد. به عنوان مثال، سدیم سیترات را ببینید:
یون سیترات با کمپلکسهای فلزی تشکیل میشود. ثابتهای پایدار برای تشکیل این مجتمعها به دلیل اثرکلات بسیار زیاد است. در نتیجه، حتی با کاتدی فلز قلیایی تشکیل میدهد. با این حال، هنگامی که یک مجموعه کلات با تمام سه گروه کربوکسیلات تشکیل میشود، حلقههای کلات دارای ۷ و ۸ عضو هستند که عموماً از نظر ترمودینامیکی پایدارتر از حلقههای کوچکتر کلات است. اسید سیتریک را میتوان در یک یا چند گروه کارکردی اسید کربوکسیلیک بر روی مولکول (با استفاده از انواع مختلف الکلها) استرید کرد تا هر یک از انواع استرهای mono, di, tri و mixed را تشکیل دهند.
کاربرد اسید سیتریک در صنایع غذایی
تولیدات پنیر
در صنعت پنیر سازی از اسیدسیتریک استفاده میشود، بهویژه در پنیر موزارلا اسید سیتریک بعنوان کاتالیست جهت تخمیر سریع شیر استفاده میشود. تخمیر سریع به این منظور است که در مقادیر زیاد میتوان پنیر بیشتری را در مدت کمتری تولید کرد.
افزایش عمرمفید
باکتری برای زنده ماندن به (pH) پایدار نیاز دارد. اسید سیتریک با کاهش PH محیط از رشد باکتری جلوگیری میکند در نتیجه باعث افزایش عمر مفید غذاهای فراوری شده بهطور چشمگیری میشود. بهعنوان مثال مرباها و ژلهها، غذاهای کنسروی، محصولات گوشتی و دیگر غذاها.
طعم
اسید سیتریک علاوه بر افزایش ماندگاری نوشیدنیهای گازدار و آبمیوهها، طعم ترش خوشایندی را نیز به آنها میدهد.
امولسیفایر
اسید سیتریک مثل امولسیفایر چربی گیاهی عمل میکند. چون چربیها لخته نمیشوند، این امر باعث میشود که بستنی و لیموناد بافت و طعم همگن و مطلوبی داشته باشند.
نوشیدنیهای گازدار
زمانیکه اسید سیتریک با سدیم بیکربنات مخلوط شود، گازدار میشود. در واقع تقریباً ۵۰٪ تولیدات اسید سیتریک در این نوع نوشیدنیها استفاده میشود. مثل نوشیدنیهای گازدار و پودری و قرصهای برطرف کننده اسید معده.
آب جو
چون اسیدسیتریک یک اسید ضعیف است گاهی اوقات برای ایجاد یک محیط اسیدی در تولیدات آبجو استفاده میشود.
تسریع جذب
بسیاری از ویتامینها و مواد معدنی رایج در یک محیط اسیدی بهتر کار میکنند. اسید سیتریک در مکملهای غذایی برای تسریع جذب استفاده میکنند. همچنین بدون اسید سیتریک، قرص ویتامین C کاملاً تلخ است.
منابع
- ↑ Dawson, R. M. C.; et al. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ↑ "Data for Biochemical Research". ZirChrom Separations, Inc. Retrieved January 11, 2012.
- ↑ "Ionization Constants of Organic Acids". Michigan State University. Retrieved January 11, 2012.
- ↑ Alexander Apelblat (۲۰۱۴). Citric Acid. صص. ۱. شابک ۳-۳۱۹-۱۱۲۳۳-۳.
- ↑ Apleblat, Alexander (2014). Citric acid. Springer. ISBN 978-3-319-11232-9.
- ↑ "Global Citric Acid Markets Report, 2011-2018 & 2019-2024". prnewswire.com. 19 March 2019. Retrieved 28 October 2019.
- ↑ Verhoff, Frank H.; Bauweleers, Hugo (2005), "Citric Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a07_103.pub3
- ↑ "Citric Acid Market Size, Share & Analysis | Industry Report, 2018-2025". www.grandviewresearch.com. Retrieved 2021-01-07.
کلمات کلیدی
اسید سیتریک - سیتریک اسید
: