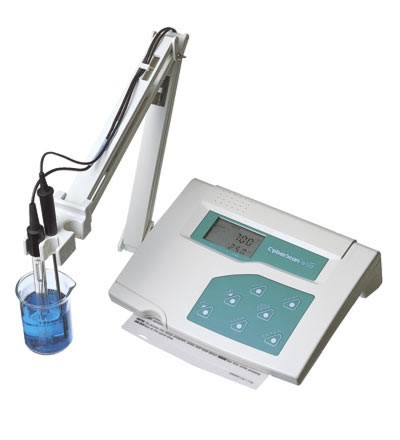
اندازه گيري PH يكي از متداولترين تكنيكهاي تجزيه است كه براي تعيين قدرت اسيدي يا بازي يك نمونه مورد استفاده قرار مي گيرد. اين كمييت با استفاده از معرف هاي رنگي اسيد و باز (به صورت كاغذ يا محلول با مقياس رنگي ) وبه روش الكترونيكي مي تواند انجام گيرد. اندازه گيري PH به روش الكترونيكي به كمك يك الكترود انجام مي گيرد.الكترود يك سنسور الكترو شيميائي است كه شامل يك الكترود شناساگر و يك الكترود مرجع ا ست. ولتاژ غشا مطابق PH محلول نمونه تغيير مي كند الكترودهاي معمولي كه امروزه به كار برده مي شوند. طوري ساخته مي شوند كه ولتاژ غشاء انها در ۷=PH صفر ميلي ولت است.
جهت خرید دستگاه pH متر لطفا با تلفن 09125344368 یا 88920648 تماس حاصل فرمائید
جهت خرید انواع pH متر قلمی و پرتابل و رومیزی از کمپانیهای Hanna و AZ و میلیواکی مارتینی و WTW و جنوی وآکوالیتیک و سارتریوس و متروم و متلر به روی عکس کلیک کنید
تاریخچه:
تاریخچه اندازه گیری مقدار اسیدی مایعات بصورت الکتریکی در سال ۱۹۰۶ آغاز شد زمانیکه ماکس کرمر (Max Cremer) در مطالعات خود بر روی واسط های مایع (بر هم کنش بین مایعات و جامدات) دریافت که واسط بین مایعات می تواند با پف کردن یک حباب کوچک شیشه ای و قرار دادن یک مایع داخل آن و دیگری در بیرون مورد مطالعه قرار گیرد. به این روش ولتاژ الکتریکی ایجاد شد که قابل اندازه گیری بود.
این نظریه توسط فریتز هاربر Fritz Haber (کسی که پیوند بین آمونیاک و کود شیمیایی را بوجود آورد.) و زیگمن کلمسویچ Zygmunt Klemsiewicz کشف کرد که حباب شیشه ای (که او آنرا الکترود شیشه ای نامید) می تواند برای اندازه گیری فعالیت یون هیدروژن استفاده شود و اینکه تابع لگاریتم می باشد.
متخصص بیوشیمی دانمارکی سورن سورنسن Soren Sorensen مقیاس PH را در سال ۱۹۰۹ بوجود آورد.
بدلیل اینکه مقدار مقاومت دیواره شیشه بسیار بالا می باشد ، معمولا بین ۱۰ تا MΩ ۱۰۰، ولتاژ الکترود شیشه ای تا قبل از اختراع تیوبهای الکترونی نمی توانست دقیقا اندازه گیری شود. بعدها اختراع ترانزیستورهای اثر میدانی (FETs) و مدارات مجتمع(ICs) با جبران حرارتی، اندازه گیری دقیق ولتاژ الکترود شیشه ای را ممکن ساخت.
ولتاژ تولید شده توسط یک واحد PH مثلا از (۸٫۰۰- ۷٫۰۰=PH) معمولا حدود mv60 می باشد. اگر چه PH سنجهای کنونی شامل ریزپردازنده هایی هستند که امکان تصحیح دما و کالیبراسیون را دارند، هنوز هم PH سنجهای مدرن مشکل رانش(تغییرات تدریجی) را دارند و ضرورت کالیبراسیون مکرر آنها را باعث میشود.
اصلاحات انجام شده در شیمی شیشه باعث شد تا آلودگیهای ناشی از یونهای نمک و هالوژن متوقف شود. الکترود مرجع، که بطور سنتی از کلرید نقره استفاده میشد(AgCl) با الکترود جیوه سفید(HgCl2) در محلول کلرید پتاسیم(KCl) بعنوان ژل (شبیه ژلاتین) جایگزین شد. اما الکترودها عمر دائمی ندارند و زمانیکه رانش آنها از حد قابل قبول فراتر رفت یا زمان تثبیت طولانی شد باید تعویض شوند.
PH سنج چگونه کار می کند؟
زمانیکه دو فلز باهم تماس پیدا می کنند با توجه به تفاوت تحرک الکترون درآنها اختلاف ولتاژ بوجود می آید. مشابه با این وقتی که یک فلز با یک مایع اسیدی یا نمکی تماس پیدا کند پتانسیل الکتریکی بوجود می آید که منتج به اختراع باطریها شد. به همین ترتیب در تماس دو مایع با یکدیگر نیز پتانسیل الکتریکی ایجاد میشود اما برای جداسازی دو مایع از یکدیگر نیاز به یک غشاﺀ(membrane) می باشد.
یک PH سنج در اصل پتانسیل الکتروشیمی بین یک مایع معلوم در داخل الکترود شیشه ای و یک مایع مجهول در بیرون را اندازه گیری میکند. بدلیل اینکه حباب شیشه ای نازک بیشتر به یونهای کوچک و سریع الانتقال هیدروژن اجازه فعل و انفعال با شیشه را میدهد، الکترود شیشه ای پتانسیل الکتروشیمی یونهای هیدروژن یا پتانسیل هیدروژن را اندازه میگیرد. برای تکمیل مدار الکتریکی به یک الکترود مرجع نیاز می باشد.توجه داشته باشید که دستگاه فقط ولتاژ الکتریکی را می سنجد نه جریان را، با این حال برای تشکیل یک پل هدایت به الکترود شیشه ای نشتی جزئی یونها از الکترود مرجع لازم میباشد. PH سنج نباید برای مایعات عبوری با رسانایی کم استفاده شود(بنابراین اندازه گیری در داخل محفظه های کوچک ترجیح داده می شود).
PH سنج پتانسیل الکتریکی(نقشه را در جهت ساعتگرد از طرف اندازه گیر تعقیب کنید) بین کلرید جیوه در الکترود مرجع و مایع کلرید پتاسیم آن، مایع مجهول، محلول داخل الکترود شیشه ای، و پتانسیل بین این محلول و کلرید نقره را اندازه می گیرد. ولی تنها پتانسیل بین مایع مجهول و محلول داخل الکترود شیشه ای از یک نمونه به نمونه دیگری تغییر میکند. بنابراین مابقی ولتاژها بدون حضور در معادله سنجیده می شوند.
الکترود مرجع جیوه سفید شامل یک تیوب شیشه ای با یک الکترود کلرید پتاسیم(KCl) در تماس نزدیک با المان کلرید جیوه در انتهای المان KCl میباشد. این یک ترکیب شکننده است، که با یک نوک اتصال مایع از جنس سرامیک متخلخل یا ماده ای مشابه در تماس می باشد. این نوع الکترودها به سادگی با فلزات سنگین و سدیم آلوده نمی شوند.
الکترود شیشه ای شامل یک تیوب سفت شیشه ای است که یک حباب شیشه ای نازک به آن متصل می باشد.داخل آن محلول معلوم کلرید پتاسیم(KCl) بعنوان بافر ۷=PH می باشد.یک الکترود نقره ای با نوک کلرید نقره اتصال با محلول داخلی را برقرار می سازد. برای کم کردن تداخل الکترونیکی، پراب با یک غلاف ورقه ای محافظت شده است، غالبا در داخل الکترود شیشه ای یافت می شود.
بسیاری از PH سنج های مدرن یک پراب ترمیستور دمایی دارند که اجازه تصحیح خودکار دما زمانیکه PH در اثر دما تغییر می کند را می دهد.
آب مهمترین و معجزه آساترین ماده روی زمین است. مولکولهای آن H-O-H به شکل یک بومرنگ با O- با تمایل به منفی و H2+ با تمایل جزئی به مثبت باردار می شوند. این بومرنگ های باردار شده به سوی همدیگر جذب شده، جزیره هایی از پیوستگی مولکولی تشکیل می دهند، بدینگونه آب در دماهایی که زندگی اوج میگیرد شکل مایع میگیرد، در حالی که باید یک گاز بسیار فرار مانند سولفید هیدروژن(H2S) میشد که تقریبا دو برابر وزن مولکولی آنرا دارا می باشد.نگهداری یک PH سنج به انواع الکترود استفاده شده بستگی دارد.توصیه های شرکت سازنده را مطالعه کنید. وقتی الکترود بطور متناوب استفاده میشود بهتر است که مرطوب نگه داشته شود، نظر به اینکه مرطوب کردن یک الکترود خشک زمان زیادی می گیرد با رانش آشکار همراه خواهد بود.
در سطح زمین، آب در شکل جامد(یخ)، مایع(آب) و شکل گاز(بخار آب یا مه) یافت میشود. در نواحی سرد هر سه حالت پیدا میشوند.
آب همچنین بدلیل دارا بودن دو حالت اسیدی با یونهای (H+) وباز(با یونهای(OH-) منحصر بفرد میباشد.و بدینگونه هر دو حالت اسیدی و بازی در یک زمان، سبب میشوند که در آب به طور طبیعی مقدار یونهای H+ با OH- مساوی باشند. بدلیل پیوستگی مولکولی قوی که آب دارد فقط تعداد کمی از مولکولهای آن به یونهای تشکیل دهنده خود یونهای هیدروژن(H+) و یونهای (OH-) تفکیک میشوند. شیمیدانها مصرند که یونهای H+ همان یونهای H3O+ یا هیدرونیوم می باشند.
با دانستن اینکه یک مول از آب ۱۸ گرم (۱۶+۱+۱) وزن دارد که معادل ml18 میشود و اینکه این مقدار شامل تعداد بسیار زیادی مولکول می باشد، فقط ۰٫۱ میلیون(۷-۱۰) مول در یک لیتر از آب با ۷=PH تفکیک(تجزیه) میشوند.
اختلاف ولتاژ بین درون و بیرون الکترود شیشه ای با اکسیدهای سیلیکون در کناره شیشه بوجود می آید.
Si.O- + H3.O+ = Si.O.H+ + H2.O
زمانی که تعادل یونی برقرار شد، اختلاف پتانسیل بین دیواره شیشه و محلول با معدله زیر داده میشود:
E=R*T/(F*ln(a)
که:
E= ولتاژ الکترون(ولت)
R= ثابت مول گازی J/mol/ºK 8.314
F= ثابت فارادی ۹۶۴۸۵٫۳ºC
T= دما بر حسب درجه کلوین
a= فعالیت یونهای هیدروژن(یونهای هیدرونیوم)
Ln(a)= لگاریتم طبیعی که به لگاریتم دهدهی تبدیل میشود= Log(a)*2.303
R*T/(F*ln(a)ترکیب
به ازای هر د ه برابر افزایش در یونهای هیدروژن یا یک واحد PH تقریبا(۶۰mV)0.060V می باشد.
PH از محدوده ۰ تا ۱۴ برای فعالیت هیدرونیوم از ۱۰ تا ۱۴-۱۰ mol/lit نسبت داده میشود. یک مول از آب ۱۸ گرم وزن دارد.۷=PH به اکتیوایی هیدرونیوم ۷-۱۰ mol/lit مربوط میشود. چونکه ۷=(۷-۱۰)log، مقیاس PH یک علامت منفی در بیرون باقی میگذارد.
اگر چه الکترودهای شیشه ای مدرن پیشرفت های قابل توجهی داشته اند، هنوز با مواد با +H پایین مانند: هیدروکسیدهای قلیایی(NaOH و KOH) ، آب مقطر خالص، مواد حکاکی با اسید مانند فلورید، مواد جاذب مانند فلزات سنگین و پروتئین ها سازگاری ندارند.
بسیاری از PH سنج های مدرن با سنسورهای دمایی برای تصحیح خطای دمایی بصورت خودکار در داخل آنها ساخته میشوند تا نتایج همانند زمانی باشد که در دمای استاندارد Cº۲۵ گرفته میشوند.
مقدار خروجی در ۷=PH تحت تاثیر دما قرار نمی گیرد، اما خارج از آن به ازای هر یک درجه جابجایی دما ۰٫۰۰۳ تغییر خواهیم داشت.Cº/۰٫۰۰۳
بنابراین PH گرفته شده در دمای ۵ درجه سانتیگراد (۲۰ درجه کمتر از ۲۵ درجه سانتیگراد) که مقدار ۴٫۰۰ را نشان میدهد باید تصحیح نقصانی بصورت زیر صورت گیرد.
۰٫۱۸=۳٫۰۰ * ۲۰ * ۰٫۰۰۳
همچنین مقدار PH برابر با ۱۰ باید به همین مقدار تصحیح افزایشی داشته باشد.
————————————————————————————
به هر حال در PH سنج های مدرن برای جلوگیری از خشک شدن الکترودشان با آب شیر یا کلرید پتاسیم شستشو داده میشوند. در صورت اندازه گیری آب دریا، PHسنج می تواند با آب دریا مرطوب نگه داشته شود. به هر حال برای زمانهای طولانی، پیشنهاد میشود تا با محلول کلرید پتاسیم در ۴=PH یا با بافر کالیبراسیون اسیدی ۴٫۰۱=PH مرطوب نگه داشته شود. قرار دادن PH سنجها در آب مقطر توصیه نمی شود.
توجه داشته باشید پراب PHی که در محلول اسیدی مرطوب بماند، اگر قبل از گذاشتن آن در شیشه نمونه شستشو نشود می تواند روی نتایج تاثیر بگذارد. توجه داشته باشید که یک مایع با ۴=PH ، ۱۰٫۰۰۰ یون هیدروژن بیشتر از یک مایع با ۸=PH دارد، بنابراین یک قطره از ۴=PH در شیشه نمونه ای که ۴۰۰ قطره با ۸=PH را اندازه میگیرد اندازه ها را بهم می زند. همچنین به یاد داشته باشیدمحلولهای کالیبراسیون از بافرهای شیمیایی تشکیل می شوند که سعی میشود مقدار PH آنها ثابت نگه داشته میشود، بنابراین آلودگی شیشه نمونه با یک بافر واقعا خطرناک میباشد.
مقیاس PH
زمانی که مقادیر PH با مواد معلوم مقایسه شود، بیشتر قابل فهم میشود. توجه داشته باشید که مقیاس PH لگاریتمی بوده و هر مقدار بعدی ۱۰ برابر کمتر یونهای هیدروژن دارد. ۰=PH بیشترین مقدار را دارا بوده و بالاترین میزان اسید را دارد.
نکته مهمي که در مورد استفاده از الکترود pH وجود دارد اين است که از قرار دادن اين الکترود در محلولهايي که با نقره واکنش ميدهند خودداري کنيد.
اگر الکترود pH را به مدت طولاني در آب مقطر قرار دهيد بخاطر اينکه الکترود حاوي KCl است و آب مقطر فاقد آن، به تدريج KCl موجود در الکترود وارد آب مقطر ميگردد و بالطبع باعث ايجاد اختلال در کار الکترود ميشود.
تميز کردن غشاي شيشه اي الکترود pH :
اکثرا براي کاليبره کردن الکترود از بافرهاي استاندارد با pH هاي ۴ و ۷ استفاده ميشود. اگر الکترود، pH اين بافرها را دقيق نشان نداد يکي از علتهاي آن ميتواند آلوده بودن غشاي شيشه اي الکترود باشد.
براي تميز کردن غشاي شيشه اي الکترود، نوک آن را در محلول ۰٫۱ M اسيد کلريدريک به مدت ۱۵ ثانيه قرار دهيد وبعد با آب مقطر شستشو دهيد. سپس آنرا در محلول ۰٫۱ M سود به مدت ۱۵ ثانيه قرار دهيد و پس از اتمام ۱۵ ثانيه با آب مقطر شستشو دهيد. اين اعمال را چند با تکرار کنيد.
حال دوباره pH بافرها را چک کنيد. اگر باز هم اشکال برطرف نشده باشد، نوک الکترود را به مدت ۳۰ ثانيه در محلول ۲۰% آمونيوم بي فلورايد يا به مدت ۱۵ ثانيه درمحلول ۱۰% هيدروفلوئوريک اسيد قرار دهيد. سپس با آب مقطر شستشو دهيد.در مرحله بعد نوک الکترود را به مدت ۳۰ ثانيه در اسيد کلريدريک غليظ قرار دهيد.(اين عمل براي حذف باقيمانده احتمالي فلوئوريد از روي غشاي شيشه اي است) سپس با آب مقطر بخوبي شستشو دهيد.
الکترود را به مدت يک ساعت در بافر با pH= 4 قرار دهيد. سپس عملکرد الکترود را بيازماييد اگر مشکل برطرف نشده باشد احتمالا بايد الکترود را عوض کنيد.
دانلود فایل نحوه صحیح نگهداری از الکترود
منبع http://lab.m-iau.ac.ir/?p=47