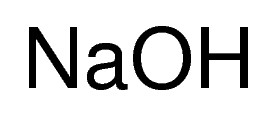آزمیران
دستگاهای آزمایشگاهی
مواد شیمیایی
شیشه آلات
محیط کشتهای میکروبی
فیلتر یا کاغذ صافی
ملزومات
سکوبندی
مقالات و توضیحات
جستجوهای مرتبط
سدیم هیدروکسید 1 کیلوئی کد S8045 کمپانی سیگما آلدریچ
اعتبار قیمت 98.5.28
شماره CAS 1310-73-2 فرمول خطی سود وزن مولکولی 40.00 شماره EC 215-185-5 شماره MDL MFCD00003548 پابکم شناسه ماده 329824595
هیدروکسید سدیم BioXtra، ≥98 ((اسیدومتریک) گلوله (بی آب)
برگه های اطلاعات ایمنی (SDS) برگه مشخصات (PDF) محصولات مشابه
SKU اندازه بسته اندازه بسته در دسترس بودن پریس (یورو) انزال
S8045-500G
بالا
سفارش ایمنی و مستندات پروتکل ها و ماده (1) تکنیک اسناد و مدارک (arber کار می کند) 1318
ایگنشافن
مقولات مرتبط اسیدها و بازها، بازها، مواد شیمیایی سنتز، هسته Bioreagents، مواد شیمیایی ضروری،
بیشتر ...
چگالی بخار> 1 (در مقابل هوا)
فشار بخار <18 میلی متر جیوه (20 درجه سانتیگراد)
3 میلی متر جیوه (37 درجه سانتیگراد)
-M از Inchi کلیدی HEMHJVSKTPXQMS-UHFFFAOYSA
خط تولید BioXtra
سنجش ≥98٪ (اسیدومتریک)
فرم گلوله ها (بی آب)
نمایش بیشتر (22)
توصیف
بسته بندی
1 کیلوگرم در بطری پلی
500 گرم در بطری پلی
کاربرد
از هیدروکسید سدیم استفاده شده است:
• برای تنظیم pH در محلول ها [1]
• در فرآیند ضایعات سلول ها از صفحه کشت [2]
• برای تهیه محلول فرمالدئید [3]
• برای بهداشت ستون کروماتوگرافی [4]
امنیتی Informen
نماد GHS05 GHS05 کلمه سیگنال خطر اظهارات خطر H290 H314-اظهارات احتیاطی P260-P280-P303 P361 + + P353-P304 P340 + + P310-P305 P351 + + P338 RIDADR سازمان ملل متحد 1823 8 / PGII WGK آلمان 1 RTECS WB4900000
سدیم هیدروکسید (به انگلیسی: Sodium hydroxide) یا سود سوزآور (به انگلیسی: Caustic Soda) ترکیبی معدنی با فرمول شیمیایی NaOH است. این ماده یک ترکیب یونی جامد سفیدرنگ است که از کاتیون سدیم (+Na) و آنیون هیدروکسید (-OH) تشکیل شده است. این ترکیب، در تماس با پوست می تواند سوختگی شیمیایی شدید ایجاد کند. سدیم هیدروکسید به شدت در آب انحلال پذیر بوده و به راحتی رطوبت و کربن دی اکسید موجود در هوا را جذب می کند.
شناساگرها
شماره ثبت سیایاس
۱۳۱۰-۷۳-۲ ✔
پابکم
۱۴۷۹۸
کماسپایدر
۱۴۱۱۴ ✔
UNII
55X04QC32I ✔زبان
شمارهٔ ئیسی
215-185-5
شمارهٔ یواِن
1823
KEGG
D01169 ✔
MeSH
Sodium+Hydroxide
ChEBI
CHEBI:32145 ✔
شمارهٔ آرتیئیسیاس
WB4900000
مرجع جیملین
68430
جیمول-تصاویر سه بعدی
Image 1
SMILES
O[Na]
InChI
InChI=1S/Na.H2O/h;1H2/q+1;/p-۱ ✔
Key: HEMHJVSKTPXQMS-UHFFFAOYSA-M ✔
InChI=1/Na.H2O/h;1H2/q+1;/p-۱
Key: HEMHJVSKTPXQMS-REWHXWOFAM
خصوصیات
فرمول مولکولی
NaOH
جرم مولی
39.9971 g mol-1
شکل ظاهری
White waxy opaque crystals
چگالی
2.13 g cm−3
دمای ذوب
۳۱۸ درجه سلسیوس (۶۰۴ درجه فارنهایت؛ ۵۹۱ کلوین)
دمای جوش
1388 °C, 1661 K, 2530 °F
انحلالپذیری در آب
1110 g dm-3 (at 20 °C)
انحلالپذیری در methanol
238 g dm-3
انحلالپذیری در ethanol
<<139 g dm-3
فشار بخار
<2.4 kPa (at 20 °C)
اسیدی (pKa)
13
ضریب شکست (nD)
1.412
ترموشیمی
آنتروپی مولار
استاندارد So298
64.46 J K-1 mol-1
آنتالپی استاندارد
تشکیل ΔfHo298
-425.93 kJ mol-1
خطرات
MSDS
External MSDS
GHS pictograms
The corrosion pictogram in the Globally Harmonized System of Classification and Labelling of Chemicals (GHS)
شاخص ئییو
۰۱۱-۰۰۲-۰۰-۶
طبقهبندی ئییو
خورنده C
کدهای ایمنی
R۳۵
شمارههای نگهداری
(S1/2), S26, S37/39, S45
لوزی آتش
NFPA 704 four-colored diamond
ALK
تاریخچه ویرایش
سدیم هیدروکسید در ابتدا توسط سازندگان صابون تولید میشد.[۵] دستورالعملی از ساخت سدیم هیدروکسید توسط دانشمند مسلمان قرن ۱۳ میلادی "المختاره" در کتاب " المخترع في فنون من الصنع " یافت شدهاست که توسط "المظفر یوسف ابن عمر ابن علی ابن رسول" پادشاه یمن گردآوری شدهاست. شیمیدان و باستانشناس انگلیسی "هنری ارنست استپالتون (۱۸۷۸–۱۹۶۲)" شواهدی ارائه دادهاست که محمد زکریای رازی سدیم هیدروکسید را میشناختهاست.[۶] این دستورالعمل شامل گذراندن پی در پی آب از درون مخلوطی از قلیا (که خاکستر علف شور saltwort بود) و آهک خام بود که به این روش سدیم هیدروکسید بدست میآمد. صابون سازان اروپایی همین دستورالعمل را پیروی میکردند.[۷]
روشهای تهیه ویرایش
الکترولیز محلول سدیم کلرید ویرایش
بیشترین مقدار هیدروکسید سدیم تولیدی، از طریق فرایند الکترولیز محلولهای سدیم کلرید در یکی از انواع ظروف الکترولیتی بدست میآید. به عنوان نمونه، در فرایند پیل جیوه (کاستنر-کلنر Castner-Kellner)، از جریانی از جیوه به عنوان کاتد استفاده میشود و ملغمه سدیم حاصل با آب ترکیب میشود و تولید سدیم هیدروکسید مینماید و در فرایند دیگر به نام پیل دیافراگم، الکترولیت از آند به کاتد حرکت میکند و دیافراگم (از جنس پنبه کوهی یا سایر مواد غشایی)، فراوردههای آند و کاتد را از هم جدا میسازد. در هر دو فرایند، علاوه بر سدیم هیدروکسید، گاز کلر و نیز گاز هیدروژن تولید میشود.
فرایند سودا-آهک ویرایش
یک فرایند قدیمیتر برای تولید سود سوزآور، عبارت از فرایند سودا - آهک میباشد که در آن سودا اَش (کلسیم هیدروکسید)، در واکنش با سدیم کربنات به کاستیک سودا تبدیل میشود.
کاربردها ویرایش
سدیم هیدروکسید، به عنوان یک باز قوی، یکی از مواد شیمیایی صنعتی بسیار مهم بهشمار میرود. برای نمونه، تولید سود در سال ۱۹۸۰ در آمریکا، ۱۲ میلیون تن بودهاست. تولید این ماده شیمیایی پایه؛ که در تولید تمامی انواع مواد شیمیایی به نحوی کاربرد دارد، از ۶۰۳۹۰ کیلوتن در سال ۲۰۱۲ به ۷۲۱۰۳ کیلوتن در سال ۲۰۱۶ افزایش یافت که میانگین رشد ۴٫۵۳ درصد است. چین بزرگترین تولیدکننده سود جهان است که ۴۵٫۵۵ درصد از سهم بازار در صنعت سدیم هیدروکسید را در سال ۲۰۱۶ داشت. در بازار مصرف، چین و آمریکای شمالی، اصلیترین مصرفکنندههای این ماده هستند که برآورد شده به ترتیب ۴۲٫۷۹٪ و ۲۰٫۲۹٪ در سال ۲۰۱۶ مصرف کردهاند.[۸] زمینههای مختلف کاربرد سدیم هیدروکسید از جمله در تولید مواد شیمیایی، ابریشم مصنوعی، خمیر کاغذ و کاغذ، در تولید رنگ، آلومینیوم، مواد پتروشیمی و پارچه، صابون و مواد شوینده است.
همچنین در آزمایشگاهها برای تعیین غلظت اسیدهای مجهول درتیتراسیون اسید- باز از محلول قلیایی سدیم هیدروکسید استاندارد استفاده میشود. در صنایع غذایی از این ماده جهت تلخی زدایی از زیتون استفاده میشود. سود سوزآور در دو نوع مایع و جامد در کارخانهها تولید میشود.
کاربردهای سود کاستیک پرک (به انگلیسی: Caustic Soda Flakes) در صنعت بسیار وسیع است، صنایع مختلف با رویکردهای مختلف از این ماده استفاده میکنند. برخی از این صنایع عبارتند از:
صنایع رنگرزی
تولید کارتن و کاغذ
صنایع چرم و نساجی
صنایع نفت و گاز و پترو شیمی
خنثیسازی اسید و باتری سازی
چربی گیرها و سایر صنایع وابسته
صنایع غذائی، صنایع شیر، کنسرو سازی
نوشابه سازی، کارخانه قند و شکر، کارخانه روغن
صنایع دارو سازی، الکلسازی و آرایشی و بهداشتی
صنایع فلزی و تولید شیشه روی، آلومینیوم، گالوانیزه و آبکاری
سود پرک کاربرد فراوانی در صنعت نفت و گاز دارد
سود پرک کاربرد فراوانی در صنایع نظامی دارد.
سود پرک برای صنایعی که با عوامل بیماریزا مواجه میشوند هم کاربرد دارد.
سود پرک در صنعت پلیمر و پت هم مصرف فراوانی دارد لذا به عنوان چربی بر استفاده میشود.
آزمایشهای آن ویرایش
اگر سدیم هیدروکسید را با هیدروکلریک اسید مخلوط کنیم مادهای به نام سدیم کلرید بوجود میآید. در طی این واکنش گاز هیدروژن نیز آزاد میشود. علاوه بر این واکنش، واکنشی نیز بین سدیم هیدروکسید و نیتریک اسید نیز وجود دارد که در طی این واکنش سدیم نیترات بوجود میآید. نحوه ساخت سدیم هیدروکسید نیز روش جالب و بسیار بسیار سادهای است. این واکنش این چنین است که سدیم را درون آب میریزیم در صورتی که مقدار سدیم زیاد باشد خطر آتشسوزی و انفجار نیز وجود دارد.
واکنش با فلزات ویرایش
سدیم هیدروکسید در واکنش با فلز آلومینیوم گاز هیدروژن تولید میکند.
2Al + 2 NaOH + 6 H2O → 2 NaAl(OH)4 + 3 H
فروشنده: فروشگاه
گارانتی اصالت و سلامت کالا
پشتیبانی ۷ روز هفته ۲۴ ساعته
۹۹۰,۰۰۰ تومان